Антибиотикопрофилактика при цистите
Цистит — одно из наиболее распространённых инфекционных заболеваний мочевыводящих путей (ИМП), чаще всего встречающееся среди женщин: около 50–60% сталкиваются с этим заболеванием хотя бы раз в жизни1, а у 10% оно переходит в хроническую рецидивирующую форму2. В последние годы антибиотикопрофилактика стала широко применяться для предотвращения рецидивов цистита, однако такая практика породила ряд вопросов, т. к. ее эффективность сопровождается рисками, связанными с частым или длительным применением антибиотиков3. Данная статья освещает современные подходы к антибиотикопрофилактике цистита и помогает принять решение в отношении ведения пациентов с хроническим рецидивирующим циститом.
Факторы риска развития рецидивирующего цистита
- эктопия наружного отверстия уретры, иногда даже на передней стенке влагалища5;
- анатомические дефекты, приводящие к застою, обструкции или рефлюксу мочи;
- цистоцеле, уретероцеле и мочевые свищи;
- функциональные нарушения (гиперактивный мочевой пузырь и недержание мочи);
- обструкция мочеиспускательного канала или нейрогенный мочевой пузырь (у пожилых мужчин);
- интралюминальные (камни в мочевом пузыре, новообразования, встроенные катетеры, стенты, инородные тела), интрамуральные (стеноз/стриктуры мочеточника) и экстрамуральные (фиброз или новообразование) поражения;
- неадекватное/неполноценное лечение начальной стадии острого цистита, антибиотикорезистентность6.
Алгоритмы диагностики рецидивирующего цистита
Антибиотикопрофилактика: современные рекомендации
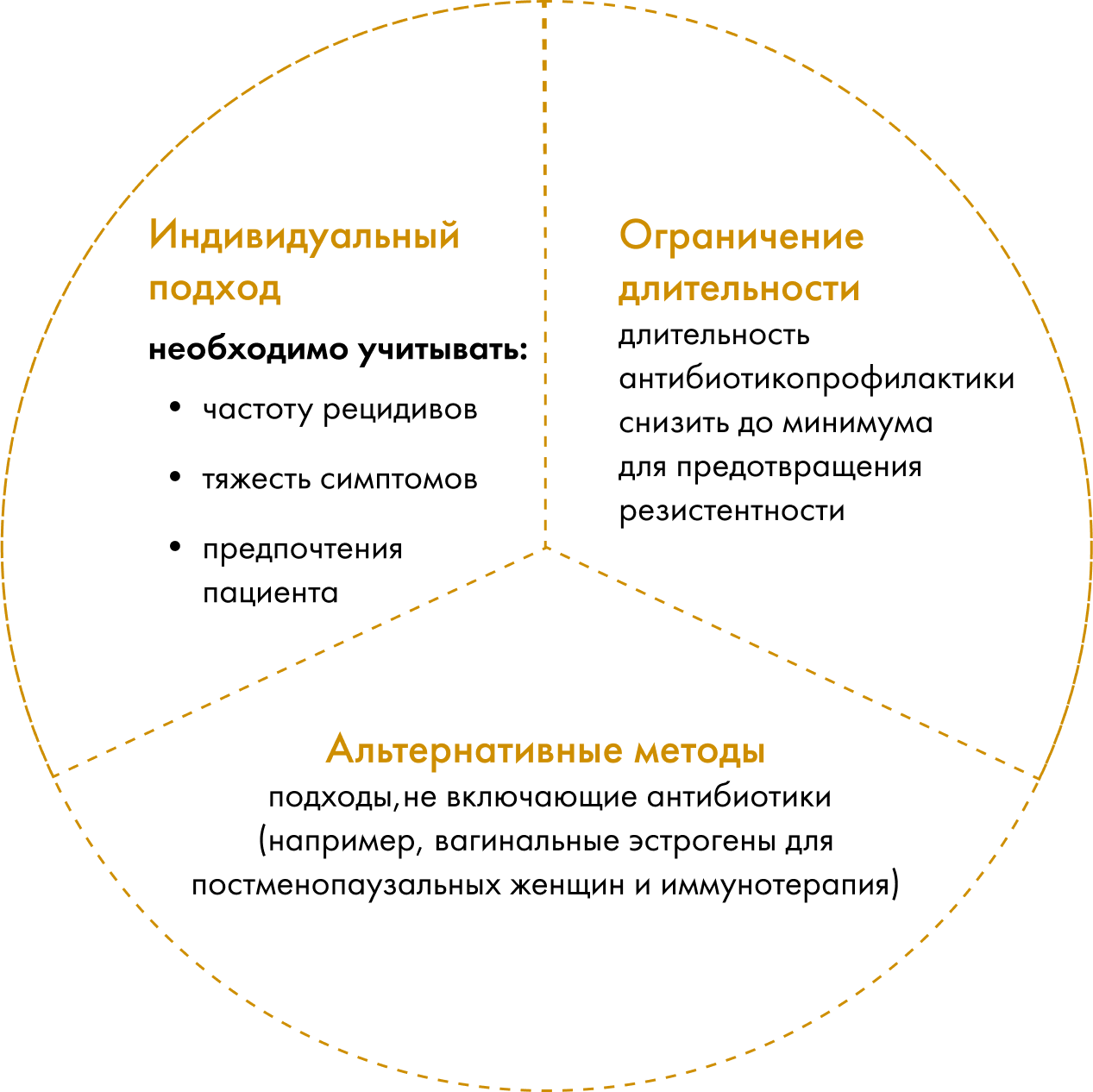
Применение в течение 3-6 месяцев.
Препараты выбора: производные нитрофуранов и фосфомицин.
Приём одной дозы антибиотика после полового акта (особенно эффективен для женщин с рецидивами, связанными с сексуальной активностью).
Альтернатива антибиотику (особенно у женщин без аномалий мочевых путей).
Однако, несмотря на доказанную эффективность антибиотикопрофилактики при хроническом рецидивирующем цистите, данный подход сопряжен с рядом рисков.
По данным многочисленных исследований и научных обзоров, наиболее частыми нежелательными явлениями на фоне длительного приема антибиотиков являются:
Выбор препарата для антибиотикопрофилактики рецидивирующего цистита
(доступные)
(контролируемые)
(резервные)
Низкий потенциал к развитию резистентности
Нитрофурантоин
Фосфомицин
(перорально)
(доступные)
(контролируемые)
Фосфомицин
(перорально)
(резервные)
Заключение
Антибиотикопрофилактика остаётся эффективным методом предотвращения рецидивов цистита, однако её применение должно быть строго обоснованным и индивидуализированным. Учитывая риски развития резистентности и нарушения микрофлоры, необходимо тщательно выбирать препарат для профилактики ИМП.
Фурагин — оригинальный нитрофуран для лечения и профилактики цистита.
Список ссылок и сокращений:
- Medina M, Castillo-Pino E. An introduction to the epidemiology and burden of urinary tract infections. Ther Adv Urol. 2019 May 2;11
- Аполихин О. И., Вагенленер Ф., Войтко Д. А., Золотухин О. В., Набер К., Назаренко Д. Г., Перепанова Т. С., Просянников М. Ю., Сивков А. В., Шадеркин И. А. Эпидемиологическое исследование распространенности цистита у женщин Воронежской области. Экспериментальная и клиническая урология. 2021;14(1): 10–18.
- Anger J, Lee U, Ackerman AL, Chou R, Chughtai B, Clemens JQ, et al. Recurrent Uncomplicated Urinary Tract Infections in Women: AUA/CUA/SUFU Guideline. Journal of Urology [Internet]. 2019 Aug 1 [cited 2025 Jul 9];202(2):282–9.
- Аполихина И. А. Цистит и антибиотики: как ускорить выздоровление и не дать болезни вернуться. РМЖ. 2024.
- Тетерина Т. А., Аполихина И. А., Иванова Е. А. Анатомо-функциональные особенности женской уретры: посткоитальный цистит. Медицинский оппонент. 2021; 3(15): 35–42.
- Aggarwal N, Leslie SW. Recurrent Urinary Tract Infections. StatPearls Publishing; 2025 Jan
- Ходырева Л. А., Зайцев А. В., Берников А. Н., Куприянов Ю. А., Строганов Р. В., Арефьева О. А. Острый и рецидивирующий цистит. Что нам известно? РМЖ. 2020; 11: 69–74.
- Bonkat G., Bartoletti R., Bruyère F., Cai T., Geerlings S.E., Köves B., Schubert S., Pilatz A., Veeratterapillay R., Wagenlehner F. EAU Guidelines on Urological Infections. 2025 edition. — Arnhem: European Association of Urology, 2025.
- Anger J. T., Bixler B. R., Holmes R. S., Lee U. J., Santiago-Lastra Y., Selph S. S. Updates to Recurrent Uncomplicated Urinary Tract Infections in Women: AUA/CUA/SUFU Guideline. Journal of Urology [Internet]. 2022 Sep 1 [cited 2025 May 12]; 208(3): 36–41.
- Kwok M., McGeorge S., Mayer-Coverdale J., Graves B., Paterson D. L., Harris P. N. A., Esler R., Dowling C., Britton S., Roberts M. J. Guideline of guidelines: management of recurrent urinary tract infections in women. BJU Int. 2022 Nov; 130 Suppl 3(Suppl 3): 11–22.
- Голуб А. В. Нитрофураны в терапии неосложненных инфекций мочевых путей. Эффективная фармакотерапия. Урология инефрология. 2010; (3).
- Перепанова Т. С. и др. Проблемы лечения рецидивирующей инфекции нижних мочевыводящих путей. Эффективная фармакотерапия. 2011; 43: 38–43.
- Kuzmin I. V., Al-Shukri S. K., Slesarevskaya M. N. Treatment and prophylaxis of the lower urinary tract recurrent infections in women. Urology reports (St.-Petersburg). 2019; 9(2): 5–10.
- AWaRe classification of antibiotics for evaluation and monitoring of use. 2023. Available at: https://www.who.int/publications/i/item/WHO-MHP-HPS-EML-2023.04
- Klesiewicz K., Karczewska E. et al. Comparative in vitro studies of furazidin and nitrofurantoin activities against common uropathogens including multidrug-resistant strains of E. Coli and S. Aureus, January 2018, Acta Poloniae Pharmaceutica — Drug Research 75(3): 803.
- Bielec F., Brauncajs, M., Pastuszak-Lewandoska, D. Nitrofuran Derivatives Cross-Resistance Evidence—Uropathogenic Escherichia coli Nitrofurantoin and Furazidin In Vitro Susceptibility Testing. J. Clin. Med. 2023, 12, 5166.
- Перепанова Т. С., Хазан П. Л. Применение нитрофуранов при инфекции мочевых путей. Эффективная фармакотерапия. Урология и нефрология. 2007; (20): 20–29.
- Инструкция по медицинскому применению лекарственного средства Фурагин®
- Яковлев С.В. Суворова М.П.., Обоснование выбора антибиотика при инфекциях мочевыводящих путей с акцентом на экологическую безопасность антибактериальной терапии. Урология., 2021, №4, С.97-100
